Lista de elementos
»
actinio
»
aluminio
»
americio
»
argón
»
arsénico
»
astato
»
azufre
»
bario
»
Berilio
»
berkelio
»
bismuto
»
bohrio
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbono
»
cerio
»
cesio
»
circonio
»
cloro
»
cobalto
»
cobre
»
conducir
»
criptón
»
cromo
»
curio
»
dubnio
»
erbio
»
escandio
»
estaño
»
europio
»
fermio
»
flúor
»
fósforo
»
francio
»
galio
»
germanio
»
hafnio
»
hassio
»
helio
»
hierro
»
holmio
»
indio
»
iridio
»
iterbio
»
itrio
»
lantano
»
litio
»
lutecio
»
magnesio
»
mercurio
»
neodimio
»
neón
»
neptunio
»
Nihonium
»
niobio
»
níquel
»
nobelio
»
oro
»
osmio
»
oxígeno
»
paladio
»
Plata
»
platino
»
plutonio
»
polonio
»
potasio
»
prometeo
»
radio
»
radón
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
selenio
»
silicio
»
sodio
»
talio
»
tantalio
»
tecnecio
»
telurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xenón
»
yodo
»
zinc
Xe - xenón - SIN GAS NOBLE DE METAL
El xenón es un elemento químico natural, número atómico 54, símbolo Xe y masa atómica 131.293. Es un gas noble inodoro e incoloro que se encuentra en la atmósfera terrestre en muy bajas concentraciones. Es químicamente inerte y estable en su estado normal.
El xenón tiene una masa molar de 131,3 g/mol y una presión de vapor de 16,6 kPa a 25 °C. Es más pesado que el aire ya presión atmosférica su punto de ebullición es -111,8°C. Tiene un punto de fusión de -108,1°C y una densidad relativamente baja de 4,94 g/la 25°C.
El xenón es ampliamente utilizado por sus propiedades refrescantes y luminosas. Se utiliza para producir luces fluorescentes y para aplicaciones médicas como escáneres de rayos X o láseres de xenón. También se utiliza para inflar neumáticos, producir rayos de plasma y fabricar bombas de vacío. El xenón también se usa en la industria automotriz para faros y para llenar tanques de combustible de vehículos nuevos. Además, el xenón se utiliza en la investigación científica para estudiar diversos efectos físicos y químicos, como la difusión de gases y la absorción de radiación.
El xenón tiene una masa molar de 131,3 g/mol y una presión de vapor de 16,6 kPa a 25 °C. Es más pesado que el aire ya presión atmosférica su punto de ebullición es -111,8°C. Tiene un punto de fusión de -108,1°C y una densidad relativamente baja de 4,94 g/la 25°C.
El xenón es ampliamente utilizado por sus propiedades refrescantes y luminosas. Se utiliza para producir luces fluorescentes y para aplicaciones médicas como escáneres de rayos X o láseres de xenón. También se utiliza para inflar neumáticos, producir rayos de plasma y fabricar bombas de vacío. El xenón también se usa en la industria automotriz para faros y para llenar tanques de combustible de vehículos nuevos. Además, el xenón se utiliza en la investigación científica para estudiar diversos efectos físicos y químicos, como la difusión de gases y la absorción de radiación.
Sintético
Radiactivo
Liquido
Gaseoso
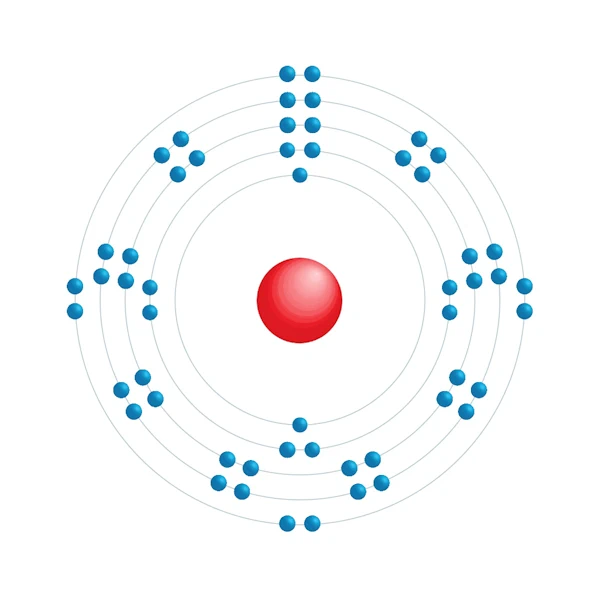
Diagrama de configuración electrónica
| Apellido | xenón |
| Número | 54 |
| Atómico | 131.293 |
| Símbolo | Xe |
| Fusión | -111.9 |
| Hirviendo | -107 |
| Densidad | 0.005887 |
| Período | 5 |
| Grupo | 18 |
| Descubrimiento | 1898 Ramsay and Travers |
| Abundancia | 0.001 |
| Radio | 1.2 |
| Electronegatividad | 0 |
| Ionización | 12.1298 |
| Número de isótopos | 31 |
| Configuración electrónica | [Kr] 4d10 5s2 5p6 |
| Estados de oxidación | 2,4,6,8 |
| Electrón por nivel de energía | 2,8,18,18,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se