Lista de elementos
»
actinio
»
aluminio
»
americio
»
argón
»
arsénico
»
astato
»
azufre
»
bario
»
Berilio
»
berkelio
»
bismuto
»
bohrio
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbono
»
cerio
»
cesio
»
circonio
»
cloro
»
cobalto
»
cobre
»
conducir
»
criptón
»
cromo
»
curio
»
dubnio
»
erbio
»
escandio
»
estaño
»
europio
»
fermio
»
flúor
»
fósforo
»
francio
»
galio
»
germanio
»
hafnio
»
hassio
»
helio
»
hierro
»
holmio
»
indio
»
iridio
»
iterbio
»
itrio
»
lantano
»
litio
»
lutecio
»
magnesio
»
mercurio
»
neodimio
»
neón
»
neptunio
»
Nihonium
»
niobio
»
níquel
»
nobelio
»
oro
»
osmio
»
oxígeno
»
paladio
»
Plata
»
platino
»
plutonio
»
polonio
»
potasio
»
prometeo
»
radio
»
radón
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
selenio
»
silicio
»
sodio
»
talio
»
tantalio
»
tecnecio
»
telurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xenón
»
yodo
»
zinc
O - oxígeno - OTROS NO METÁLICOS
El oxígeno (símbolo químico O) es un elemento químico de la familia de los calcógenos, subgrupo 16 de la tabla periódica de elementos. Es el principal componente de la atmósfera terrestre, representando alrededor del 20,9% del volumen total.
El oxígeno es un compuesto muy reactivo y, por lo tanto, muy importante para muchas reacciones químicas. Es el tercer elemento más abundante en el universo después del hidrógeno y el helio. Es capaz de formar enlaces covalentes con otros átomos y puede combinarse con ellos para formar moléculas más complejas como compuestos orgánicos. El oxígeno es un gas en su estado normal, es un gas incoloro, inodoro e insípido. Su fórmula química es O2 y su masa molar es de 32 g/mol.
El oxígeno es un gas muy reactivo ya que tiene ocho electrones en su capa externa de electrones. Es un oxidante fuerte y es muy útil en diversas reacciones químicas. También es muy soluble en agua y es la principal fuente de oxígeno disponible para los seres vivos. El oxígeno también es combustible y se usa mucho en industrias y laboratorios por sus propiedades oxidantes.
El oxígeno es el componente principal de los combustibles fósiles y, por lo tanto, es muy importante en el proceso de combustión. Es ampliamente utilizado para diversas aplicaciones industriales, incluida la fabricación de metales, productos químicos, fertilizantes, medicamentos y productos farmacéuticos. Además de los usos industriales, el oxígeno se utiliza en tratamientos médicos para ayudar a personas con enfermedades respiratorias graves. También es utilizado por muchas industrias como la aeronáutica, la astronáutica y los deportes extremos.
El oxígeno es un compuesto muy reactivo y, por lo tanto, muy importante para muchas reacciones químicas. Es el tercer elemento más abundante en el universo después del hidrógeno y el helio. Es capaz de formar enlaces covalentes con otros átomos y puede combinarse con ellos para formar moléculas más complejas como compuestos orgánicos. El oxígeno es un gas en su estado normal, es un gas incoloro, inodoro e insípido. Su fórmula química es O2 y su masa molar es de 32 g/mol.
El oxígeno es un gas muy reactivo ya que tiene ocho electrones en su capa externa de electrones. Es un oxidante fuerte y es muy útil en diversas reacciones químicas. También es muy soluble en agua y es la principal fuente de oxígeno disponible para los seres vivos. El oxígeno también es combustible y se usa mucho en industrias y laboratorios por sus propiedades oxidantes.
El oxígeno es el componente principal de los combustibles fósiles y, por lo tanto, es muy importante en el proceso de combustión. Es ampliamente utilizado para diversas aplicaciones industriales, incluida la fabricación de metales, productos químicos, fertilizantes, medicamentos y productos farmacéuticos. Además de los usos industriales, el oxígeno se utiliza en tratamientos médicos para ayudar a personas con enfermedades respiratorias graves. También es utilizado por muchas industrias como la aeronáutica, la astronáutica y los deportes extremos.
Sintético
Radiactivo
Liquido
Gaseoso
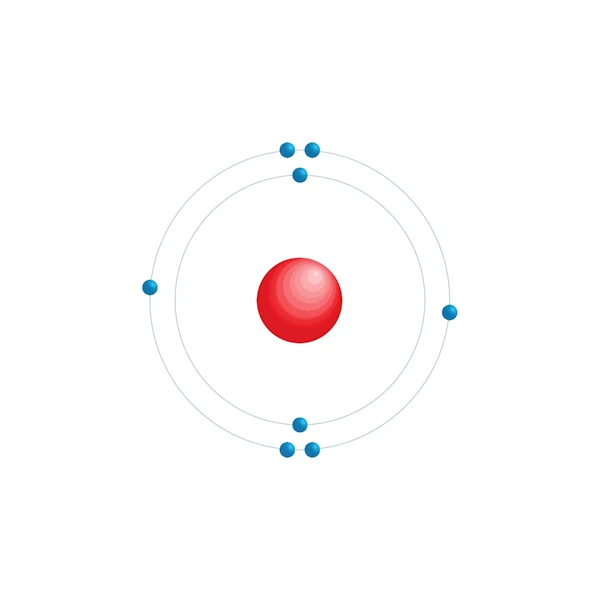
Diagrama de configuración electrónica
| Apellido | oxígeno |
| Número | 8 |
| Atómico | 15.9992 |
| Símbolo | O |
| Fusión | -218.4 |
| Hirviendo | -182.9 |
| Densidad | 0.001429 |
| Período | 2 |
| Grupo | 16 |
| Descubrimiento | 1774 Priestley/Scheele |
| Abundancia | 461000 |
| Radio | 0.65 |
| Electronegatividad | 3.44 |
| Ionización | 13.6181 |
| Número de isótopos | 8 |
| Configuración electrónica | [He] 2s2 2p4 |
| Estados de oxidación | -2,-1,1,2 |
| Electrón por nivel de energía | 2,6 |
| Mineral | Dureza | Densidad |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Abernathyite | 2.00 / 3.00 | 3.31 |
| Abhurite | 2.00 / 2.00 | 4.29 |
| Abswurmbachite | 6.50 / 6.50 | 4.96 |
| Abuite | ||
| Acetamide | 1.00 / 1.50 | 1.17 |
| Achalaite | ||
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Acuminite | 3.50 / 3.50 | 3.30 |
| Adachiite | ||
| Adamite | 3.50 / 3.50 | 4.30 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Addibischoffite | ||
| Adelite | 5.00 / 5.00 | 3.73 |
| Admontite | 2.00 / 3.00 | 1.82 |
| Adolfpateraite | 2.00 / 2.00 | 4.24 |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Adrianite | ||
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Aerugite | 4.00 / 4.00 | 5.85 |
| Aeschynite-(Ce) | 5.00 / 6.00 | 5.19 |
| Aeschynite-(Nd) | 5.00 / 6.00 | 4.60 |
| Aeschynite-(Y) | 5.00 / 6.00 | 4.85 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Afmite | ||
| Afwillite | 3.00 / 3.00 | 2.62 |
| Agaite | 6.99 | |
| Agakhanovite-(Y) | 6.00 / 6.00 | 2.67 |
| Agardite-(Ce) | 3.00 / 3.00 | 3.72 |
| Agardite-(La) | 3.00 / 4.00 | 3.72 |
| Agardite-(Nd) | 3.00 / 4.00 | 3.72 |
| Agardite-(Y) | 3.00 / 4.00 | 3.66 |
| Agata | 6.50 / 7.00 | 2.60 |
| ágata musgosa | 6.00 / 6.50 | 2.60 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Agricolaite | 4.00 / 4.00 | 3.53 |
| Agrinierite | 5.62 | |
| Aguamarina | 7.50 / 8.00 | 2.70 |
| Aheylite | 5.00 / 6.00 | 2.85 |
| Ahlfeldite | 2.00 / 2.50 | 3.37 |
| Ahrensite | 4.14 | |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Akaganeite | 3.00 | |
| Akaogiite | ||
| Akatoreite | 6.00 / 6.00 | 3.48 |
| Akdalaite | 7.00 / 7.00 | 3.68 |
| Akermanite | 5.00 / 6.00 | 2.94 |
| Akhtenskite | 4.00 | |
| Akimotoite | ||
| Aklimaite | ||
| Akrochordite | 3.50 / 3.50 | 3.19 |
| Aksaite | 2.50 / 2.50 | 1.99 |
| Alamosite | 4.50 / 4.50 | 6.49 |
| Alanita | 5.50 / 5.50 | 3.30 |
| Alarsite | 3.00 / 3.00 | 3.32 |
| Albertiniite | 2.46 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Albrechtschraufite | 2.00 / 3.00 | 2.60 |
| Alcaparrosaite | 4.00 / 4.00 | 2.81 |
| Aldermanite | 2.00 / 2.00 | 2.00 |
| Aldridgeite | 3.00 / 3.00 | 3.33 |
| Aleksandrovite | 4.00 / 4.50 | 3.07 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Alforsite | 5.00 / 5.00 | 4.73 |
| Alfredopetrovite | 2.50 / 2.50 | 2.50 |
| Alfredstelznerite | ||
| Aliettite | 1.00 / 2.00 | |
| Allactite | 4.50 / 4.50 | 3.00 |
| Allanite-(La) | 6.00 / 6.00 | 3.93 |
| Allanite-(Nd) | ||
| Allanite-(Y) | 5.50 / 5.50 | 3.30 |
| Allanpringite | 3.00 / 3.00 | 2.54 |
| Alleghanyite | 6.00 / 5.00 | 4.00 |
| Allendeite | 4.84 | |
| Allochalcoselite | 3.00 / 4.00 | 4.65 |
| Allophane | 3.00 / 3.00 | 1.90 |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almandine | 7.00 / 8.00 | 4.09 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Almeidaite | ||
| Alnaperbøeite-(Ce) | ||
| Alpersite | 2.50 / 2.50 | |
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Alstonite | 4.00 / 4.50 | 3.69 |
| Althausite | 3.50 / 3.50 | 2.97 |
| Althupite | 3.50 / 4.00 | 3.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(K) | 2.00 / 2.00 | 1.76 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Aluminite | 1.00 / 1.00 | 1.66 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se