Lista de elementos
»
actinio
»
aluminio
»
americio
»
argón
»
arsénico
»
astato
»
azufre
»
bario
»
Berilio
»
berkelio
»
bismuto
»
bohrio
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbono
»
cerio
»
cesio
»
circonio
»
cloro
»
cobalto
»
cobre
»
conducir
»
criptón
»
cromo
»
curio
»
dubnio
»
erbio
»
escandio
»
estaño
»
europio
»
fermio
»
flúor
»
fósforo
»
francio
»
galio
»
germanio
»
hafnio
»
hassio
»
helio
»
hierro
»
holmio
»
indio
»
iridio
»
iterbio
»
itrio
»
lantano
»
litio
»
lutecio
»
magnesio
»
mercurio
»
neodimio
»
neón
»
neptunio
»
Nihonium
»
niobio
»
níquel
»
nobelio
»
oro
»
osmio
»
oxígeno
»
paladio
»
Plata
»
platino
»
plutonio
»
polonio
»
potasio
»
prometeo
»
radio
»
radón
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
selenio
»
silicio
»
sodio
»
talio
»
tantalio
»
tecnecio
»
telurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xenón
»
yodo
»
zinc
C - carbono - OTROS NO METÁLICOS
El carbono es un elemento químico esencial para la vida y para la fabricación de productos de todo tipo. Se representa con el símbolo C y se encuentra en abundancia en el medio ambiente como carbono orgánico (como en el carbón, hidrocarburos, etc.) y en forma inorgánica (como dióxido de carbono [CO2], monóxido de carbono [CO], etc.). Es un elemento vital de la vida organizada en la Tierra.
El carbono es incoloro, inodoro y se combina con otros elementos para formar compuestos orgánicos e inorgánicos. Se considera uno de los tres elementos que juegan un papel importante en la química orgánica (junto con el hidrógeno y el oxígeno). El carbono se une consigo mismo y con otros elementos para formar moléculas cuyas propiedades están determinadas por el tipo de enlace entre los átomos de carbono.
El carbono es un elemento versátil y las moléculas que forma pueden tener diferentes propiedades. Las propiedades más importantes del carbono son la conductividad eléctrica, la resistencia térmica y la capacidad de absorber humedad. Los productos hechos de carbono son ampliamente utilizados en la industria y en la vida cotidiana. Los principales productos a base de carbono son combustibles, plásticos, tintes, tintas, acero, textiles y productos químicos para cosméticos y medicamentos.
El carbono es también un elemento importante para la producción y almacenamiento de energía. El carbono se utiliza para generar energía en las centrales eléctricas y se puede almacenar en forma de carbón, gas natural y petróleo. Los combustibles fósiles se pueden convertir en energía a partir del carbono que contienen. El carbono también se puede almacenar en forma de biomasa (materia orgánica vegetal o animal), dióxido de carbono o productos químicos a base de carbono.
El carbono es incoloro, inodoro y se combina con otros elementos para formar compuestos orgánicos e inorgánicos. Se considera uno de los tres elementos que juegan un papel importante en la química orgánica (junto con el hidrógeno y el oxígeno). El carbono se une consigo mismo y con otros elementos para formar moléculas cuyas propiedades están determinadas por el tipo de enlace entre los átomos de carbono.
El carbono es un elemento versátil y las moléculas que forma pueden tener diferentes propiedades. Las propiedades más importantes del carbono son la conductividad eléctrica, la resistencia térmica y la capacidad de absorber humedad. Los productos hechos de carbono son ampliamente utilizados en la industria y en la vida cotidiana. Los principales productos a base de carbono son combustibles, plásticos, tintes, tintas, acero, textiles y productos químicos para cosméticos y medicamentos.
El carbono es también un elemento importante para la producción y almacenamiento de energía. El carbono se utiliza para generar energía en las centrales eléctricas y se puede almacenar en forma de carbón, gas natural y petróleo. Los combustibles fósiles se pueden convertir en energía a partir del carbono que contienen. El carbono también se puede almacenar en forma de biomasa (materia orgánica vegetal o animal), dióxido de carbono o productos químicos a base de carbono.
Sintético
Radiactivo
Liquido
Gaseoso
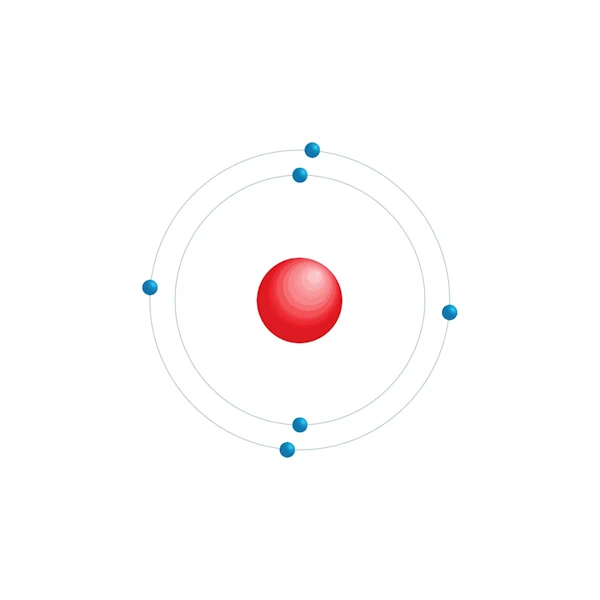
Diagrama de configuración electrónica
| Apellido | carbono |
| Número | 6 |
| Atómico | 12.0112 |
| Símbolo | C |
| Fusión | 3550 |
| Hirviendo | 4827 |
| Densidad | 2.267 |
| Período | 2 |
| Grupo | 14 |
| Descubrimiento | 0 Prehistoric |
| Abundancia | 200 |
| Radio | 0.91 |
| Electronegatividad | 2.55 |
| Ionización | 11.2603 |
| Número de isótopos | 7 |
| Configuración electrónica | [He] 2s2 2p2 |
| Estados de oxidación | -4,-3,-2,-1,1,2,3,4 |
| Electrón por nivel de energía | 2,4 |
| Mineral | Dureza | Densidad |
| Abelsonite | 2.00 / 2.50 | 1.45 |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Acetamide | 1.00 / 1.50 | 1.17 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Agaite | 6.99 | |
| Agricolaite | 4.00 / 4.00 | 3.53 |
| Albrechtschraufite | 2.00 / 3.00 | 2.60 |
| Alexkhomyakovite | ||
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alstonite | 4.00 / 4.50 | 3.69 |
| Alumohydrocalcite | 2.50 / 2.50 | 2.23 |
| Ámbar | 2.00 / 2.50 | 1.10 |
| Amonita | 6.00 / 7.00 | 3.20 |
| Ancylite-(Ce) | 4.50 / 4.50 | 3.90 |
| Ancylite-(La) | 4.00 / 4.50 | 3.88 |
| Andersonite | 2.50 / 2.50 | 2.79 |
| Ankerite | 3.50 / 4.00 | 3.00 |
| Antipinite | 2.00 / 2.00 | 2.55 |
| Aragonita | 3.50 / 4.00 | 2.93 |
| Arisite-(Ce) | ||
| Arisite-(La) | 3.00 / 3.50 | 4.07 |
| Armangite | 4.00 / 4.00 | 4.43 |
| Artinite | 2.50 / 2.50 | 2.00 |
| Ashburtonite | 4.69 | |
| Ashcroftine-(Y) | 5.00 / 5.00 | 2.61 |
| Astrocyanite-(Ce) | 2.00 / 3.00 | 3.80 |
| Aurichalcite | 2.00 / 2.00 | 3.64 |
| Azurita | 3.50 / 4.00 | 3.77 |
| Balliranoite | ||
| Barbertonite | 1.50 / 2.00 | 2.10 |
| Barentsite | 3.00 / 3.00 | 2.56 |
| Barringtonite | 2.83 | |
| Barstowite | 3.00 / 3.00 | 5.50 |
| Barytocalcite | 4.00 / 4.00 | 3.64 |
| Bastnäsite-(Ce) | 4.00 / 5.00 | 4.95 |
| Bastnäsite-(La) | 4.00 / 5.00 | 4.95 |
| Bastnäsite-(Nd) | 4.00 / 4.50 | 5.23 |
| Bastnäsite-(Y) | 4.00 / 4.50 | 4.90 |
| Bayleyite | 2.05 | |
| Baylissite | 2.00 | |
| Benstonite | 3.00 / 4.00 | 3.60 |
| Beyerite | 2.00 / 3.00 | 6.56 |
| Bijvoetite-(Y) | 2.00 / 2.00 | 3.90 |
| Biraite-(Ce) | 5.00 / 5.00 | 4.76 |
| Birunite | 2.00 / 2.00 | 2.36 |
| Bismutite | 4.00 / 4.00 | 7.00 |
| Blatonite | 2.00 / 3.00 | 3.99 |
| Bonshtedtite | 4.00 / 4.00 | 2.95 |
| Borcarite | 4.00 / 4.00 | 2.77 |
| Bosoite | ||
| Bradleyite | 3.00 / 4.00 | 2.73 |
| Braunerite | ||
| Brenkite | 3.10 | |
| Brianyoungite | 2.00 / 2.50 | 3.93 |
| Britvinite | 3.00 / 3.00 | 5.51 |
| Brugnatellite | 2.00 / 2.00 | 2.14 |
| Burbankite | 3.50 / 3.50 | 3.50 |
| Burkeite | 3.50 / 3.50 | 2.57 |
| Bussenite | 4.00 / 4.00 | 3.63 |
| Bütschliite | 2.00 | |
| Calcioancylite-(Ce) | 4.00 / 4.50 | |
| Calcioancylite-(Nd) | 4.00 / 4.50 | |
| Calcioburbankite | 3.00 / 4.00 | 3.45 |
| Calcita | 3.00 / 3.00 | 2.71 |
| Calclacite | 1.00 | |
| Caledonite | 2.50 / 3.00 | 5.70 |
| Calkinsite-(Ce) | 2.50 / 2.50 | 3.27 |
| Callaghanite | 3.00 / 3.50 | 2.71 |
| Camérolaite | 3.10 | |
| Canavesite | 1.80 | |
| Cancrinite | 6.00 / 6.00 | 2.40 |
| Cancrisilite | 5.00 / 5.00 | 2.40 |
| Caoxite | 2.00 / 2.50 | 1.85 |
| Carboborite | 2.00 / 2.00 | 2.12 |
| Carbobystrite | 6.00 / 6.00 | 2.37 |
| Carbocernaite | 3.00 / 3.00 | 3.53 |
| Carbokentbrooksite | 5.00 / 5.00 | 3.14 |
| Carbonate-fluorapatite | 5.00 / 5.00 | 3.12 |
| Carbonate-hydroxylapatite | 5.00 / 5.00 | 3.00 |
| Carbonatecyanotrichite | 2.00 / 2.00 | 2.65 |
| Carborandita | ||
| Caresite | 2.00 / 2.00 | 2.57 |
| Carletonite | 4.00 / 4.50 | 2.45 |
| Carpathite | 1.50 / 1.50 | 1.29 |
| Carraraite | ||
| Carrboydite | 2.50 | |
| Caysichite-(Y) | 4.50 / 4.50 | 3.03 |
| Cebaite-(Ce) | 4.50 / 5.00 | 4.81 |
| Cebaite-(Nd) | 4.50 / 5.00 | 4.80 |
| Cejkaite | 3.67 | |
| Cerusita | 3.00 / 3.50 | 6.50 |
| Chalconatronite | 1.00 / 2.00 | 2.27 |
| Chanabayaite | 2.00 / 2.00 | 1.46 |
| Chaoite | 1.00 / 2.00 | 3.33 |
| Charmarite | ||
| Chibaite | 6.50 / 7.00 | 1.93 |
| Chlorartinite | 1.87 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se