Lista de elementos
»
actinio
»
aluminio
»
americio
»
argón
»
arsénico
»
astato
»
azufre
»
bario
»
Berilio
»
berkelio
»
bismuto
»
bohrio
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbono
»
cerio
»
cesio
»
circonio
»
cloro
»
cobalto
»
cobre
»
conducir
»
criptón
»
cromo
»
curio
»
dubnio
»
erbio
»
escandio
»
estaño
»
europio
»
fermio
»
flúor
»
fósforo
»
francio
»
galio
»
germanio
»
hafnio
»
hassio
»
helio
»
hierro
»
holmio
»
indio
»
iridio
»
iterbio
»
itrio
»
lantano
»
litio
»
lutecio
»
magnesio
»
mercurio
»
neodimio
»
neón
»
neptunio
»
Nihonium
»
niobio
»
níquel
»
nobelio
»
oro
»
osmio
»
oxígeno
»
paladio
»
Plata
»
platino
»
plutonio
»
polonio
»
potasio
»
prometeo
»
radio
»
radón
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
selenio
»
silicio
»
sodio
»
talio
»
tantalio
»
tecnecio
»
telurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xenón
»
yodo
»
zinc
Ar - argón - SIN GAS NOBLE DE METAL
El argón es un elemento químico de la familia de los gases nobles, de símbolo Ar y número atómico 18. Se produce por separación fraccionada de gases presentes en el aire, principalmente por oxígeno y nitrógeno. Es inodoro, incoloro e inerte.
El argón es un gas inerte en estado gaseoso, que forma moléculas de ocho átomos (Átomos de argón – Ar8). Su masa molar es 39,948 g/mol. Sus características lo hacen muy estable en ambientes asépticos. Es el tercer gas noble más abundante en la atmósfera, constituyendo el 0,94% del aire. Su temperatura de ebullición y presión de vapor se saturan a –186°C y 0,52 MPa respectivamente.
El argón es un mal conductor térmico y eléctrico y, por lo tanto, se utiliza para soldar y rellenar productos electrónicos y para rellenar lámparas fluorescentes. También se utiliza como gas de protección, ya que no es combustible y no reacciona con otras moléculas.
El argón se usa en muchas aplicaciones, incluida la metalurgia, para apagar incendios, para fabricar productos químicos y aislamiento, para llenar lámparas fluorescentes y para inertizar recipientes presurizados y recintos donde se usan altas temperaturas. El argón también se utiliza en el análisis de cromatografía de gases para separar mezclas y medir la concentración de gases individuales. Finalmente, el argón se utiliza para la fabricación de medicamentos, por ejemplo, el analgésico lidocaína.
El argón es un gas inerte en estado gaseoso, que forma moléculas de ocho átomos (Átomos de argón – Ar8). Su masa molar es 39,948 g/mol. Sus características lo hacen muy estable en ambientes asépticos. Es el tercer gas noble más abundante en la atmósfera, constituyendo el 0,94% del aire. Su temperatura de ebullición y presión de vapor se saturan a –186°C y 0,52 MPa respectivamente.
El argón es un mal conductor térmico y eléctrico y, por lo tanto, se utiliza para soldar y rellenar productos electrónicos y para rellenar lámparas fluorescentes. También se utiliza como gas de protección, ya que no es combustible y no reacciona con otras moléculas.
El argón se usa en muchas aplicaciones, incluida la metalurgia, para apagar incendios, para fabricar productos químicos y aislamiento, para llenar lámparas fluorescentes y para inertizar recipientes presurizados y recintos donde se usan altas temperaturas. El argón también se utiliza en el análisis de cromatografía de gases para separar mezclas y medir la concentración de gases individuales. Finalmente, el argón se utiliza para la fabricación de medicamentos, por ejemplo, el analgésico lidocaína.
Sintético
Radiactivo
Liquido
Gaseoso
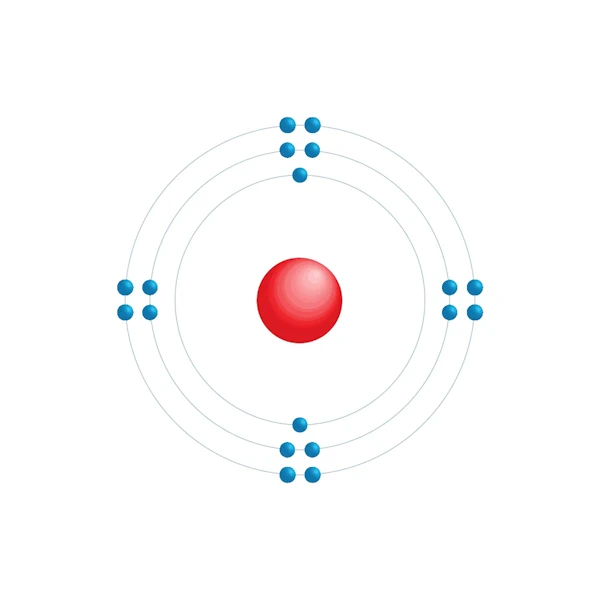
Diagrama de configuración electrónica
| Apellido | argón |
| Número | 18 |
| Atómico | 39.948 |
| Símbolo | Ar |
| Fusión | -189.4 |
| Hirviendo | -185.9 |
| Densidad | 0.0017837 |
| Período | 3 |
| Grupo | 18 |
| Descubrimiento | 1894 Rayleigh and Ramsay |
| Abundancia | 3.5 |
| Radio | 0.88 |
| Electronegatividad | 0 |
| Ionización | 15.7596 |
| Número de isótopos | 8 |
| Configuración electrónica | [Ne] 3s2 3p6 |
| Estados de oxidación | 0 |
| Electrón por nivel de energía | 2,8,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se